Історія вивчення атома. Ядерна модель атома. Квантові постулати Н.Бора. випромінювання та поглинання світла атомами. Атомні й молекулярні спектри. Спектральний аналіз та його застосування
1. Будова атома
1.1. Модель атома Томсона
До 1902 р. було здійснено достатньо експериментів, які переконливо довели, що електрон є однією з основних складових частин будь-якої речовини.

^ показав на основі класичної електромагнітної теорії, що розміри електрона повинні бути близько 10−15 м.
Крім того, було відомо, що розміри атомів становлять кілька ангстрем (один ангстрем дорівнює 10−10 м). На цій підставі Томсон 1903 р. запропонував модель атома, відповідно до якої атоми являють собою однорідні кулі з позитивно зарядженої речовини, у якій перебувають електрони.

Сумарний заряд електронів дорівнює позитивному заряду атома. Тому атом загалом електрично нейтральний. Ця модель одержала назву «пудинг», тому що електрони були вкраплені в позитивно заряджене середовище подібно до родзинок у пудингу.
Відхилення електрона в атомі від положення рівноваги призводить до виникнення повертальної сили. Тому електрон, виведений у певний спосіб з положення рівноваги, здійснює коливання, а тому є джерелом електромагнітного випромінювання.
Модель Томсона здавалася привабливою з того погляду, що передбачала наявність електронів в атомі. Однак вона проіснувала тільки до 1911 року.
1.2. Досліди Резерфорда
Резерфорд запропонував своїм співробітникам експериментально перевірити заможність моделі атома Томсона. Ідея досліду була проста. Якщо модель атома Томсона відповідає дійсності, то, пропускаючи через дуже тонку металеву плівку вузький пучок швидких α-частинок, експериментатори не повинні виявити скільки-небудь помітного відхилення цих частинок.
Резерфорд установив, що кожна α-частинка, потрапляючи на екран із сірчистого цинку, спричиняє спалах світла. Розсіявшись у золотій фользі, α-частинки потрапляли потім на екран, і їх потім реєстрував мікроскоп. Варто було сподіватися, що пучок α-частинок під час проходження через тонку фольгу злегка розпливеться на незначні кути.
Таке розсіювання на малі кути дійсно спостерігалося, але зовсім зненацька виявилося, що приблизно одна α-частинка з 20 000, що падають на золоту фольгу завтовшки всього лише 4·10−5 см , повертається назад, у бік джерела.
Резерфорду знадобилося кілька років, щоб остаточно зрозуміти настільки несподіване розсіювання α-частинок на великі кути.
Він дійшов висновку, що позитивний заряд атома зосереджений у дуже малому об’ємі в центрі атома, а не розподілений по всьому атомі, як у моделі Томсона.
1.3. Планетарна модель атома
Резерфорд зумів визначити розмір атомного ядра. І виявилося, що атомне ядро в десятки тисяч разів менше за власне атом: розмір ядра — близько 10−14 −10−15 м, в той час як розмір атома — близько 10−10 метрів.

Ґрунтуючись на своїх дослідах і розрахунках, Резерфорд запропонував планетарну модель атома:
атоми будь-якого елемента складаються з позитивно зарядженої частини, що дістала назву ядра;
до складу ядра входять позитивно заряджені елементарні частинки — протони (пізніше було встановлено, що й нейтральні нейтрони);
навколо ядра обертаються електрони, що утворюють так звану електронну оболонку.
Подібність атома до Сонячної системи посилювалося тим, що закон Кулона, що «керує» рухом електронів, збігається за формою із законом всесвітнього тяжіння, що «керує» рухом планет: і в тому, і в іншому випадку сила обернено пропорційна квадрату відстані.
1.4. Недоліки планетарної моделі атома
Попри всю переконливість планетарної моделі виникав цілий ряд нездоланних труднощів під час пояснення будови атома. Відповідно до класичної теорії, система, що складається з масивного позитивно зарядженого ядра й легких, негативно заряджених електронів, може бути стійкою тільки в тому випадку, коли електрони перебувають у русі. Таким чином, атом мав бути подібним до мініатюрної Сонячної системи, у якій роль Сонця відіграє ядро, а планет — електрон.
Аналогія була б досить повною (адже електричні й гравітаційні сили залежать від відстані, як 1/ r2 ), якби не одне передбачення класичної теорії, відповідно до якого електричні заряди, що прискорено рухаються, повинні випромінювати енергію у вигляді електромагнітних хвиль. Тому електрони, рухаючись по «планетарних» орбітах, повинні були б під час випромінювання втрачати енергію руху й у результаті швидко наближатися до ядра. Розрахунки показували, що електрон в атомі Гідрогену має випромінювати всю свою енергію за малу частку секунди. Однак в атомі цього не відбувається.
З іншого боку, якби електрони рухалися навколо ядра подібно до планет навколо Сонця, то кожний атом був би єдиним у своєму роді, тому що, відповідно до класичної механіки, кожний електрон міг би рухатися за кожною з нескінченної кількості орбіт. І тому мала б спостерігатися нескінченна розмаїтість атомів того самого хімічного елемента.
Таким чином, в «атомних масштабах» суперечить досвіду не тільки класична електродинаміка, але й класична механіка — основа основ всієї класичної фізики.
^
2.1. Квантові постулати Бора
Данський фізик Нільс Бор доповнив планетарну модель атома положеннями, які мали усунути недоліки цієї моделі.
Міркуючи над проблемою стійкості планетарного атома, Бор переконався, що «це питання просто неможливо вирішити за допомогою вже відомих правил». Бор зрозумів, що не всі закони класичної фізики придатні до явищ атомних масштабів і що для опису властивостей атомів потрібна нова — квантова — теорія.
Після декількох місяців роботи Бор 1913 року опублікував свою квантову теорію атома. Основу цієї теорії становлять постулати Бора.
1. Атомна система може перебувати тільки в певних (стаціонарних або квантових) станах, кожному з яких відповідає певна енергія En. У стаціонарному стані атом не випромінює.
2. Під час переходу атома з одного стаціонарного стану в інший відбувається випущення або поглинання кванта електромагнітної енергії. Енергія кванта дорівнює різниці енергій стаціонарних станів:  .
.
Із другого постулату Бору випливає, що атом може випромінювати й поглинати світло тільки з певними значеннями частот, які визначаються формулою  . Це так зване «правило частот».
. Це так зване «правило частот».
Якщо електрон перескакує на іншу орбіту, на якій його енергія менше, то куди подінеться надлишок енергії? Адже зникнути, перетворитися в ніщо енергія не може. «Шукайте її поза атомом!» — заявляє Бор. Вона виділяється з атома у вигляді кванта. Того самого кванта світлової енергії, що був уведений Планком, а електрон, що випромінив, рухається по орбіті, тепер уже іншій, і знову не випромінює.
Атом може не тільки випромінювати, але й поглинати фотони: під час поглинання фотона електрон в атомі переходить зі стаціонарної орбіти з меншою енергією на орбіту з більшою енергією. Коли електрони в атомі перебувають на стаціонарних орбітах з найменшою можливою енергією, говорять, що атом перебуває в основному стані. Всі інші стани атома називаються збудженими.
2.2. Наслідки постулатів Бора
Постулати Бора довели, що джерелом світла є збуджений атом.
Світло генерується під час переходу атома з одного збудженого стану в інший. Частота генерованого світла пропорційна ΔE, світло випромінюється й поглинається у вигляді квантів.
Подібність атомів того самого хімічного елемента пояснюється в теорії Бора тим, що у всіх атомах даного елемента стаціонарні орбіти електронів ті самі.
Найбільший успіх теорія Бору мала стосовно атома Гідрогену, для якого виявилося можливим побудувати кількісну теорію. Однак уже для наступного за складністю атома — атома Гелію — домогтися кількісної узгодженості з дослідом не вдалося, не кажучи вже про складніші атоми.
Подальший розвиток фізики довів, що труднощі теорії Бора були пов’язані з її внутрішньою суперечливістю, тому що в ній поєднувалися закони класичної фізики й суперечні їм постулати Бора.
2.3. Спектральний аналіз
Явище дисперсії використовують у науці й техніці для визначення складу речовини, тобто проведення спектрального аналізу.
В основі цього методу лежить вивчення світла, випромінюваного або поглинутого речовиною.
Спектральним аналізом називають метод вивчення хімічного складу речовини, заснований на дослідженні його спектрів.
Для одержання й дослідження спектрів використовують спектральні апарати. Найбільш прості спектральні прилади — призма й дифракційна решітка. Більш точні — спектроскоп і спектрограф.

Спектроскопом називається прилад, за допомогою якого візуально досліджується спектральний склад світла, яке випускає певне джерело.
Якщо реєстрація спектра відбувається на фотопластинці, то прилад називається спектрографом.
Накалені тверді й рідкі тіла й гази (за великого тиску) випромінюють світло, розкладання якого дає суцільний спектр, у якому спектральні кольори безупинно переходять один в одний.
Суцільні спектри однакові для різних речовин, і тому їх не можна використовувати для визначення складу речовини.
Збуджені атоми розріджених газів або пар випромінюють світло, розкладання якого дає лінійчастий спектр, що складається з окремих кольорових ліній. Кожний хімічний елемент має характерний для нього лінійчастий спектр. Атоми таких речовин не взаємодіють один з одним і випромінюють світло тільки певних довжин хвиль.
Ізольовані атоми певного хімічного елемента випромінюють строго визначені довжини хвиль. Це дозволяє за спектральними лініями судити про хімічний склад джерела світла.
^ строго визначені довжини хвиль.
Положення спектральних ліній лінійчастого спектра не залежить від того, якою є причина світіння газу:
нагрівання;
пропущення електричного струму й т. ін.
Розглянуті спектри називають спектрами випромінювання.
Але існують ще спектри поглинання. Щоб їх спостерігати, необхідно пропустити світло з безперервним спектром через холодний атомарний газ. Наявність темних ліній у спектрі свідчить, що відповідні світлові хвилі газ поглинає.
^ можуть випускати за даної температури.
Під час спектрального аналізу спектральні лінії порівнюють зі спектральними лініями певного хімічного елемента. Якщо відповідні довжини хвиль збігаються, це свідчить про наявність даного хімічного елемента в досліджуваному об’єкті. За інтенсивністю спектральних ліній можна визначити кількість даного хімічного елемента.
Перевага спектрального аналізу — швидкість, висока чутливість (можна виявити домішки масою 10−10 г ), можливість провести аналіз об’єкта на великій відстані від нього.
За допомогою спектральних методів було відкрито нові хімічні елементи (гелій, рубідій, цезій і т. ін.), здійснено хімічний аналіз Сонця й далеких зір. Спектральний аналіз застосовують у металургії, машинобудуванні, криміналістиці, для контролю складу напівпровідникових матеріалів.
2.4. Атомні спектри й теорія Бора
Постулати Бора пояснюють походження лінійчастих спектрів і їх закономірності. Фізики до появи теорії Бора ламали голову, намагаючись розшифрувати складні спектри.

Коли ж ^ довів, що «спектр — це біографія атомів, точніше атомних електронів», ученим полегшало. Комбінуючи різні орбіти електронів в атомі, можна обчислити всі спостережувані лінії в спектрі.
Сполучаючи положення класичної фізики зі своїми постулатами, Нільс Бор зумів обчислити енергетичні рівні електрона в атомі гідрогену й, використовуючи співвідношення  частоти випромінювання світла атомом Гідрогену, тобто знайти вид лінійчастого спектра випромінювання.
частоти випромінювання світла атомом Гідрогену, тобто знайти вид лінійчастого спектра випромінювання.
Обчислений Бором спектр атома Гідрогену збігся з раніше вимірюваним спектром, причому не тільки в області видимого світла, але й в області ультрафіолетового та інфрачервоного випромінювання.
АКТИВНІСТЬ РАДІОНУКЛІДА. ПРАВИЛА ЗМІЩЕННЯ
Алхіміки Середньовіччя мріяли про філософський камінь, що перетворював би всі речовини на золото. «Сучасна алхімія» — так назве Е. Резерфорд свою книгу про перетворення атомних ядер. Про те, як змінюється ядро під час радіоактивного випромінювання, за якими законами відбувається цей процес, ітиметься в даному параграфі.
Визначаємо радіоактивність. Вивчаємо правила зміщення Розглядаючи в § 32 радіоактивне випромінювання, ми залишили поза увагою важливе питання: що при цьому відбувається з атомами? Адже під час радіоактивного випромінювання від атомів відриваються чималі «шматки», отже, атоми мають змінитися. Провівши низку експериментів, учені довели, що радіоактивне випромінювання є наслідком розпаду ядер атомів.
Ядра атомів радіоактивних елементів здатні довільно (без жодних причин) розпадатися. Експериментальні дослідження показали, що на радіоактивний розпад не впливають зміна тиску й температури, дія магнітного та електричного полів, хімічні реакції, зменшення чи збільшення освітленості тощо. Розпад ядра супроводжується випромінюванням а-, р- чи інших частинок; само ж ядро, як правило, перетворюється на ядро атома іншого елемента.
Радіоактивність — це здатність ядер деяких хімічних елементів довільно перетворюватися на ядра інших елементів з випромінюванням мікрочастинок.
Залежно від того, які частинки випромінюються під час радіоактивного розпаду, розрізняють а-розпад, р-розпад та інші види розпадів. Встановлено, що радіоактивні перетворення ядер підкорюються так званим правилам зміщення, які вперше сформулював англійський учений Фредерік Содді (1877-1956).
Правила зміщення
1. Під час а-розпаду нуклонне число ядра атома зменшується на 4, а протонне — на 2, тому утворюється ядро елемента, порядковий номер якого в періодичній таблиці на 2 одиниці менший, ніж порядковий номер вихідного елемента.
Наприклад, відомо, що Радон (2^Кп) є а-радіоактивним (випускає ядра атома Гелію). Тому в результаті а-розпаду Радону утворюється елемент, який має порядковий номер 84 (розташований на 2 клітинки ліворуч від Радону),— це Полоній:
2. Під час р-розпаду нуклонне число ядра атоми залишається не-змінннм, а протонне збільшується на І, тому утворюється ядро.
Наприклад, Торій ( ЖІТІі ) < |( радіоактинпим елементом (нипроміння електрони). Тому під чаї- |1 розпаду Торію утворюється Протактиній елемент із порядковим номером 91 (розташований на 1 клітинку праворуч від Торію):
Оскільки в результаті радіоактивних перетворень народжуються нові елементи, учені назвали цей процес (за аналогією з хімією) ядерними реакціями.
Дізнаємося про період піврозпаду
Уявіть собі певну кількість радіоактивної речовини. Це може бути, скажімо, шматок солі Урану або газ радон, поміщений у скляну колбу. Чи можна дізнатися, яке саме ядро у речовині, що ми розглядаємо, розпадеться першим? Яке буде наступним? А яке ядро виявиться «довгожителем» і розпадеться останнім? Фізики стверджують, що дізнатися про це неможливо: розпад того чи іншого ядра радіонукліда — подія випадкова. У той же час поведінка радіоактивної речовини в цілому підлягає чітко визначеній закономірності.
Цю закономірність можна проілюструвати за допомогою такого прикладу. Якщо взяти закриту скляну колбу, що містить певну кількість радону, виявиться, що приблизно за 57 с кількість радону в колбі зменшиться вдвічі. Ще через 57 с з решти залишиться теж половина і т. д. Тому природно, що інтервал часу 57 с був названий періодом піврозпаду Радону.
Період піврозпаду — це фізична величина, що дорівнює часу, протягом якого розпадається половина наявної кількості ядер даного радіонукліда.
Період піврозпаду зазвичай позначають символом Т. Одиниця періоду піврозпаду в СІ — секунда (с).
У кожного радіоактивного ізотопу свій період піврозпаду. Наприклад, період піврозпаду Урану-238 дорівнює 4,5 млрд років, Радію-226 — 1600 років.
Для характеристики радіоактивного розпаду використовують величину, яку називають сталою радіоактивного розпаду радіонукліда (див. таблицю) і позначають символом X. Стала радіоактивного розпаду пов'язана з періодом піврозпаду.
Даємо визначення активності радіонуклідного зразка З практичної точки зору, важливою характеристикою процесу радіоактивного розпаду є швидкість, з якою розпадається той чи інший радіонуклід.
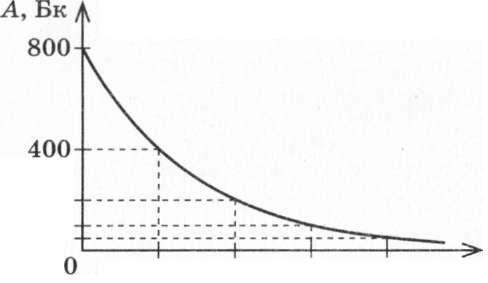
Фізична величина, яка чисельно дорівнює кількості розпадів, що відбуваються в певному радіонуклідному зразку за одиницю часу, називають активністю радіонуклідного зразка.
Активність радіонуклідного зразка позначають символом А. Одиницею активності в СІ є бекерель (Бк). 1 Бк — це активність такого зразка, в якому за 1 с відбувається 1 акт розпаду. Але 1 Бк — це дуже мала активність, тому використовують позасистемну одиницю активності.
Рис. 33.1. Активність радіонуклідного зразка.
Дізнаємося про радіоактивні ряди
Алхіміки Середньовіччя мріяли про перетворення всіх речовин на золото, тож виходить, що після експериментів Е. Резерфорда й Ф. Содді їхня мрія здійснилася? Насправді — ні. Учені з'ясували, що вихідне (як говорять фізики — материнське) ядро атома радіоактивного елемента з плином часу зазнає цілої низки перетворень. А саме: ядро атома елемента А, перетворюється на ядро атома елемента а2, потім на ядро атома елемента а3 і т. д., причому в цьому ланцюжку не може бути випадкових «гостей», скажімо, ядра атома елемента в. Сукупність усіх ізотопів, які виникають у результаті низки послідовних радіоактивних перетворень даного материнського елемента, називають радіоактивним рядом. Один із ланцюжків перетворені, (ряд Урану 23Н) показано на рис. 33.2.